Pregnant women get sick and sick women get pregnant.
Baylis F.
Premessa
Tradizionalmente la ricerca di nuovi farmaci è stata condotta prevalentemente su soggetti giovani e di sesso maschile, nell’intento di non sottoporre ai rischi delle sperimentazioni i soggetti considerati più fragili: persone anziane, donne in età fertile, in gravidanza ed allattamento, bambini[1]. Di fatto, l’esclusione dalla ricerca dei soggetti ritenuti fragili o in altro modo ‘vulnerabili’[2], determina per loro una mancanza di conoscenza degli effetti dei farmaci nella vita reale. I meccanismi d’azione dei farmaci, in questo modo, sono noti unicamente per la popolazione in studio, per la quale sono osservati in condizioni controllate e protette.
Per quanto riguarda la popolazione femminile, storicamente, l’esclusione sistematica dalla ricerca clinica ha prodotto danni concreti e misurabili[3]. Meno di un anno fa, un Commento pubblicato su Nature ha ribadito che la scarsa rappresentazione femminile negli studi clinici costituisce un problema rilevante per la sicurezza e l’efficacia delle terapie [1].
Recenti sviluppi
Per cercare di ovviare agli effetti di questa esclusione, solo apparentemente protettiva, sono state intraprese diverse misure a livello legislativo e di policy.
Già nel 2008 il Comitato Nazionale per la Bioetica proponeva linee bioetiche per una equa considerazione della donna nella sperimentazione, rilevando che “La donna non può essere assimilata all’uomo, come una mera variabile, ma ha una specificità che la sperimentazione è chiamata a tenere in considerazione per promuovere una medicina che riconosca adeguatamente le pari opportunità uomo/donna” [2].
In Italia la legge 11 gennaio 2018 ha introdotto e regolamentato la Medicina di Genere [3], integrandola nel Servizio Sanitario Nazionale (SSN) attraverso l’articolo 3, impegnando il Governo a definire un Piano per l’applicazione e diffusione della medicina di genere, con l’istituzione di un Osservatorio dedicato all’ISS [4] per monitorare l’attuazione e garantire che le differenze biologiche e socio-culturali influenzino la ricerca, la sperimentazione clinica dei farmaci (con focus su età pediatrica e sesso), la formazione sanitaria e i percorsi diagnostico-terapeutici[4].
Secondo l’ultimo rapporto sulla sperimentazione clinica in Italia (2024) le donne oggi nel nostro paese sono incluse in proporzione pressoché uguale agli uomini in tutte le fasi di studio [5].
Tuttavia, è necessario sottolineare come l’arruolamento non si traduce automaticamente in una produzione di conoscenza mirata ai bisogni di salute delle donne, infatti, nonostante si siano raggiunti numeri simili nell’arruolamento, solo l’1% del totale delle sperimentazioni è dedicata alle ‘malattie dell’apparato urogenitale femminile e complicanze della gravidanza’ [5][5].
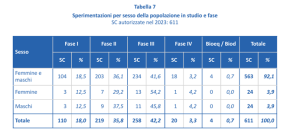
Tabella 1. Estrapolata del rapporto AIFA – Tabella 7 – La Sperimentazione Clinica dei Medicinali in Italia, 21° Rapporto Nazionale Anno 2024, Roma: Agenzia Italiana del Farmaco, 2024
Specificità della gravidanza
Se nell’inclusione delle donne (in età fertile e non) nella sperimentazione clinica sono stati fatti notevoli passi avanti, lo stesso non si può ancora dire per la sottopopolazione delle donne in gravidanza ed allattamento, condizioni queste che presentano aspetti di ulteriore complessità, essendo i soggetti da proteggere due: la donna ed il feto.
Nel 2013 Shields e colleghi indicavano che di 558 studi sponsorizzati solo 5 (1%) fossero dedicati alle donne in gravidanza, mentre su 367 studi di fase IV ben 348 (95%) le escludeva dalla partecipazione [6].
Recentemente, nel 2024, Metcalfe e colleghi con la loro revisione della letteratura hanno confermato la persistenza di questa esclusione [7]. Nella loro revisione, di 1.451 studi interventistici sul cancro al seno registrati su ClinicalTrials.gov, il 69,4% escludeva le donne in gravidanza e il 54,8% quelle in allattamento, indipendentemente dalla fase, dal disegno dello studio o dal tipo di intervento. Questi dati indicano come l’esclusione resti una pratica sistematica anche in ambiti clinici ad elevato impatto [7].
Anche le donne in gravidanza e in allattamento possono ammalarsi di cancro al seno. Secondo il National Cancer Institute, il tumore al seno associato alla gravidanza si verifica in circa 1 gravidanza su 3.000, più frequentemente nelle donne di età compresa tra 32 e 38 anni. La sua incidenza è destinata ad aumentare, in relazione sia al progressivo innalzamento dell’età media alla gravidanza sia all’aumento dell’incidenza complessiva del cancro al seno con l’età.
In questo contesto, Metcalfe e colleghi osservano come sia necessario [7]:
‘A paradigm shift is needed that focuses on how research can be used to protect pregnant people from future harms, instead of protecting pregnant people from research-related risks.’
La scarsità e spesso la mancanza di informazioni sugli effetti dei farmaci nelle donne in gravidanza è un problema che richiede maggiori attenzioni: durante la gravidanza le donne fanno spesso uso di farmaci per il trattamento di patologie acute o croniche preesistenti, nuove e/o indotte dalla gravidanza stessa. Inoltre, l’aumento dell’età media alla gravidanza si associa a una maggiore prevalenza di comorbidità e all’uso concomitante di più terapie, rendendo particolarmente necessario disporre di evidenze solide sulla sicurezza e sull’efficacia dei trattamenti in questa popolazione [8,9, 10].
Cosa dicono le raccomandazioni
Ad oggi l’inclusione delle donne incinte negli studi farmacologici è raccomandata da diverse organizzazioni, tra cui CIOMS, OMS e molto recentemente anche dallo International Council for Harmonisation che ha redatto le ICH E21 guideline on inclusion of pregnant and breastfeeding individuals in clinical trials, sottoposte da EMA a consultazione pubblica [11].
Già nel 2016 il CIOMS [12] nell’aggiornare la Linea Guida 19 – Pregnant and Breastfeeding women as research participants, affermava che:
‘Pregnant and breastfeeding women have distinctive physiologies and health needs. Research designed to obtain knowledge relevant to the health needs of the pregnant and breastfeeding woman must be promoted. Research in pregnant women must be initiated only after careful consideration of the best available relevant data’ [12].
Nel descrivere le cautele da adottare nella sperimentazione farmacologica con donne in gravidanza, il rapporto CIOMS [12] sottolineava un aspetto che ha implicazioni importanti per la farmacovigilanza, ovvero che:
‘Short-term and long‐term follow-up of the fetus and the child may be required in research involving pregnant and breastfeeding women depending upon the study intervention and its potential risks’ [12].
A distanza di pochi anni, nel 2021, l’Organizzazione Mondiale della Sanità (OMS), nel documento Research for Informed Choices: Accelerating the Study of New Drugs for HIV in Pregnant and Breastfeeding Women [13], ha ribadito che l’inclusione delle donne in gravidanza o in allattamento nella sperimentazione farmacologica richiede il superamento della definizione di categoria ‘vulnerabile’ a favore di quella di categoria ‘complessa’. Le donne in gravidanza e in allattamento, infatti, sono pienamente in grado di esprimere un consenso libero e informato alla partecipazione alla ricerca, ma presentano specificità fisiologiche, scientifiche ed etiche che richiedono un approccio metodologico dedicato [13].
Nell’assunzione dei farmaci in gravidanza, le donne non dovrebbero essere protette dalla ricerca, ma attraverso la ricerca, al fine di garantire un adeguato controllo e monitoraggio dei rischi di eventi avversi, caratteristici delle sperimentazioni cliniche [13].
Per permettere un accesso equo alla ricerca bisognerebbe dedicare ad essa parte dei fondi di ricerca.
Nel 2020 Il gruppo di lavoro del progetto PHASES (Pregnancy + HIV/AIDS: Seeking Equitable Study) [14] dedicato alla ricerca con le donne in gravidanza con HIV/AIDS in Ending the evidence gap for pregnant women around HIV & co-infections [15], ha formulato 12 raccomandazioni. (Immagine 1) per l’inclusione delle donne in gravidanza negli studi, nello specifico studi su HIV/AIDS.

Immagine 1. PHASES, Le 12 raccomandazioni dell’OMS per l’inclusione delle donne in gravidanza negli studi su HIV e AIDS[6].
Secondo le raccomandazioni PHASES [14, 15], per sostenere l’inclusione delle donne in gravidanza gli studi clinici dovrebbero essere progettati fin dal principio con questo intento, rimuovendo la gravidanza dai criteri di esclusione, e raccogliendo sulla gravidanza dati specifici.
Nelle fasi precoci dello sviluppo del farmaco (ad esempio la fase 2) si dovrebbero condurre studi preclinici di tossicologia riproduttiva animale. Le donne che rimangono incinte durante uno studio clinico dovrebbero poter rimanere nello studio e gli esiti fetali e materni delle loro gravidanze dovrebbero essere acquisiti ed analizzati insieme ad altri dati sugli esiti materni e fetali [15].
L’inclusione delle donne in gravidanza negli studi dovrebbe essere promossa dagli organismi di supervisione e dai finanziatori della ricerca, attraverso la richiesta di una giustificazione chiara e specifica ogni volta che la gravidanza sia posta come criterio di esclusione o rimozione da uno studio, e attraverso l’incentivazione di progetti di ricerca inclusivi nei bandi di finanziamento e nelle borse di studio.
I bisogni di salute delle donne in gravidanza dovrebbero essere oggetto di studio, così come quelli del feto, come sottolineato nella Raccomandazione 6 [154]:
‘Trials that include pregnant women should look for opportunities to expand the scope of data collected to include useful information about the woman as well as the neonate. At minimum, studies should be examined for opportunities to analyze data already being collected that can develop the evidence base for maternal as well as infant outcomes. [15]‘
Per quanto riguarda la sicurezza, i piani di sviluppo di nuovi farmaci dovrebbero includere studi farmacocinetici specifici per la gravidanza da eseguire il prima possibile, idealmente prima dell’autorizzazione all’immissione in commercio.
Infine, le linee guida, in particolare la Raccomandazione 8 [15] sottolineano la necessità di rafforzare la valutazione della sicurezza dei farmaci in gravidanza nella fase post-approvazione, superando i limiti dei registri attualmente disponibili. Ciò richiede un potenziamento della raccolta prospettica dei dati sugli eventi avversi[7], l’attivazione di studi di sicurezza post-marketing per i farmaci di uso frequente in gravidanza e un monitoraggio tempestivo dei segnali di sicurezza, al fine di garantire un accesso informato e sicuro alle terapie.
Secondo le principali raccomandazioni internazionali, un’inclusione equa delle donne in gravidanza o in allattamento nella ricerca clinica richiede una valutazione strutturata di specifici criteri etici e scientifici. In particolare, è necessario interrogarsi su:
| Ambito | Domanda chiave | Riferimento |
| Valore sociale | In che modo uno studio colma i gap di conoscenze per le donne in gravidanza/allattamento? | [14,15] |
| Evidenze disponibili | Sono stati condotti studi preclinici su animali?
I dati di sicurezza sono accettabili? Sono disponibili dati relativi al dosaggio e alla sicurezza nelle donne non in gravidanza? |
[13-15]
|
| Dati specifici per la gravidanza | Sono disponibili dati dalla ricerca preclinica su modelli animali in gravidanza e da studi osservazionali retrospettivi e registri di gravidanze? | [12] |
| Mitigazione dei rischi | Per interventi/procedure con potenziale beneficio individuale, i rischi saranno ridotti al minimo e compensati dal potenziale beneficio individuale per le donne in gravidanza/allattamento o per il feto/neonato?
Per interventi/procedure senza potenziale beneficio individuale per le donne in gravidanza/allattamento o per il feto/neonato, i rischi saranno solo minimi o leggermente maggiori e compensati dal valore sociale? |
[12] |
| Disegno e tempistica degli studi | L’arruolamento in studi pre-registrativi in fase avanzata sarà valutato intenzionalmente? | [14, 15] |
Il bisogno di studi e di una farmacovigilanza dedicata
L’equità nella ricerca clinica non implica automaticamente l’inclusione delle donne in gravidanza in ogni progetto di ricerca, poiché includere numeri esigui di donne in gravidanza all’interno di studi più ampi potrebbe non consentire di produrre evidenze affidabili sull’efficacia e sicurezza dei nuovi farmaci o interventi in questa popolazione [18, 19]. Quando esistono, o, sulla base delle evidenze disponibili, si presume che vi siano differenze rilevanti negli effetti rispetto ad altre sottopopolazioni, può essere appropriato progettare studi dedicati a questo sottogruppo, mentre in altri contesti, studi post-marketing e registri di gravidanza rappresentano strumenti più idonei per colmare le lacune conoscitive [19].
Ad oggi le conoscenze disponibili sui rischi ed i benefici dell’uso dei farmaci in gravidanza derivano, per la maggior parte, dalla sorveglianza post-marketing, poiché la valutazione di esiti rari, come la morte fetale od i difetti congeniti, richiede numeri elevati di pazienti e periodi di osservazione prolungati [20].
Nonostante ciò, la Farmacovigilanza in gravidanza si è storicamente sviluppata in modo frammentato, con fonti di dati eterogenee e poco integrate e con una limitata standardizzazione dei criteri di raccolta e di segnalazione.
Per rendere effettiva l’equità nella ricerca e nella pratica clinica è necessario rafforzare i sistemi di farmacovigilanza attraverso la definizione di un core set condiviso di variabili di esposizione ed esito, la raccolta di dati longitudinali di qualità e l’integrazione dei diversi flussi informativi. A tal proposito, la possibilità di collegare i dati clinici materni con quelli neonatali rappresenta una componente necessaria per la valutazione degli esiti a breve e lungo termine.
Conclusioni
Nonostante sia oggi più chiara la via da seguire per garantire il giusto coinvolgimento nella ricerca delle donne in gravidanza e allattamento, restano aperti nodi rilevanti, di natura metodologica, giuridica ed etica, che richiedono un confronto inter e transdisciplinare, necessario a garantire un reale cambio di paradigma e favorire il passaggio da una protezione delle donne dalla ricerca alla protezione attraverso la ricerca, mediante azioni pratiche e concrete, a beneficio della sicurezza dei farmaci e della salute delle donne e dei nascituri.
Sabina Gainotti, Carlo Petrini e Carmine Iorio



Bibliografia
- Singh, K.; Swarup, R. (2025). Women are poorly represented in clinical trials. That’s problematic. Nature.
- Comitato Nazionale per la Bioetica, Presidenza del Consiglio dei Ministri. La sperimentazione farmacologica sulle donne. Parere del 28 novembre 2008. Disponibile all’indirizzo: https://bioetica.governo.it/it/documenti/pareri/la-sperimentazione-farmacologica-sulle-donne/#:~:text=Il%20CNB%20propone%20linee%20bioetiche,nell’ambito%20della%20sperimentazione%20clinica.(accesso eseguito: 12 gennaio 2026)
- Repubblica Italiana. (2018). Legge 11 gennaio 2018, n. 3: Delega al Governo in materia di sperimentazione clinica di medicinali nonché disposizioni per il riordino delle professioni sanitarie e per la dirigenza sanitaria del Ministero della salute (Gazzetta Ufficiale della Repubblica Italiana, Serie Generale n. 25 del 31 gennaio 2018). https://www.gazzettaufficiale.it/eli/id/2018/1/31/18G00019/sg
- Istituto Superiore di Sanità. (2024). OSMG – L’Osservatorio sulla Medicina di Genere. Istituto Superiore di Sanità.
https://www.iss.it/osmg-l-osservatorio
- La Sperimentazione Clinica dei Medicinali in Italia 21° Rapporto Nazionale Anno 2024 Roma: Agenzia Italiana del Farmaco, 2024
- Shields, K. E., & Lyerly, A. D. (2013). Exclusion of pregnant women from industry-sponsored clinical trials. Obstetrics and gynecology, 122(5), 1077–1081. https://doi.org/10.1097/AOG.0b013e3182a9ca67
- Metcalfe, A., Stephenson, N., Cairncross, Z. F., Scime, N. V., & Fidler-Benaoudia, M. (2024). Exclusion of pregnant and lactating persons from breast cancer clinical trials: a review of active trials registered on ClinicalTrials.gov. Acta obstetricia et gynecologica Scandinavica, 103(4), 707–715. https://doi.org/10.1111/aogs.14599
- National Cancer Institute. (2025). Breast cancer during pregnancy. S. Department of Health and Human Services
https://www.cancer.gov/types/breast/breast-cancer-during-pregnancy#clinical-trials
- Biggio J. R., Jr (2020). Research in Pregnant Subjects: Increasingly Important, but Challenging. Ochsner journal, 20(1), 39–43. https://doi.org/10.31486/toj.19.0077
- Thunbo, M. Ø., Vendelbo, J. H., Witte, D. R., Larsen, A., & Pedersen, L. H. (2024). Use of medication in pregnancy on the rise: Study on 1.4 million Danish pregnancies from 1998 to 2018. Acta obstetricia et gynecologica Scandinavica,103(6), 1210–1223. https://doi.org/10.1111/aogs.14805
- European Medicines Agency. (2025). ICH E21 guideline on inclusion of pregnant and breastfeeding individuals in clinical trials (EMA/CHMP/ICH/149462/2025) https://www.ema.europa.eu/en/documents/other/ich-e21-guideline-inclusion-pregnant-breastfeeding-individuals-clinical-trials_en.pdf
- Council for International Organizations of Medical Sciences. (2016). International ethical guidelines for health-related research involving humans (4th ed.). Council for International Organizations of Medical Sciences.
https://cioms.ch/wp-content/uploads/2017/01/WEB-CIOMS-EthicalGuidelines.pdf
- World Health Organization. (2021). Research for informed choices: Accelerating the study of new drugs for HIV in pregnant and breastfeeding women. World Health Organization.
- Pregnancy + HIV/AIDS: Seeking Equitable Study (PHASES). (2020). Guidance for ending the evidence gap for pregnant women around HIV & co-infections
https://www.hivpregnancyethics.org/
- The PHASES Working Group. Ending the evidence gap for pregnant women around HIV & co-infections: A call to action. Chapel Hill, NC: July, 2020.
- Antiretroviral Pregnancy Registry. (2025). Antiretroviral Pregnancy Registry
- World Health Organization – Special Programme for Research and Training in Tropical Diseases (TDR). (2026). Central registry for epidemiological surveillance of drug safety in pregnancy.
- Baylis F. (2010). Pregnant women deserve better. Nature, 465(7299), 689–690. https://doi.org/10.1038/465689a
- van der Graaf, R., van der Zande, I. S. E., den Ruijter, H. M., Oudijk, M. A., van Delden, J. J. M., Oude Rengerink, K., & Groenwold, R. H. H. (2018). Fair inclusion of pregnant women in clinical trials: an integrated scientific and ethical approach. Trials, 19(1), 78. https://doi.org/10.1186/s13063-017-2402-9
- van der Graaf, R., van der Zande, I. S. E., & van Delden, J. J. M. (2019). How the CIOMS guidelines contribute to fair inclusion of pregnant women in research. Bioethics, 33(3), 367–373. https://doi.org/10.1111/bioe.12520
[1] Come evidenziato da Fondazione Veronesi, nei trial clinici la maggior parte dei soggetti arruolati sono di sesso maschile, circa 8 su 10, mentre solo la metà degli studi considera adeguatamente le peculiarità di genere.
[2] vulnerabile è ogni persona la cui autonomia, dignità o integrità sono suscettibili di essere minacciate, dunque anche chi, pur essendo in grado di esprimere un consenso pienamente libero e informato, si trova in condizione di fragilità e dipendenza nei confronti dei propri curanti.
[3] Kavita Singh e Renu Swarup, nel loro Commento per Nature, richiamano i dati di Irving Zucker e Brian J. Prendergast, che dimostrano come le donne sperimentino reazioni avverse ai farmaci con una frequenza quasi doppia rispetto agli uomini.
[4] Per approfondire si consiglia di consultare L’articolo dell’Istituto Mario Negri – IRCCS – Medicina di genere: cos’è, quando è nata e come funziona del 20 febbraio 2023 https://www.marionegri.it/magazine/medicina-di-genere
[5] Si fa riferimento alla tabella 9 del rapporto di AIFA del 2024 – sono 6/611 dei trial attivi era dedicato alle malattie dell’apparato urogenitale femminile e complicanze della gravidanza
[6] The material in this work is subject to copyright with a Creative Commons Attribution-NonCommercial-4.0 International (CC BY-NC4.0) license. Because PHASES encourages dissemination of its knowledge, this work may be reproduced, in whole or in part, for noncommercial purposes as long as full attribution to this work is given and changes are indicated. If you remix, transform, or build upon the material, you must distribute your contributions under the same license as the original.
The PHASES Working Group. Ending the evidence gap for pregnant women around HIV & co-infections: A call to action. Chapel Hill, NC: July, 2020
https://static1.squarespace.com/static/53f27090e4b0dbe1ff72f27c/t/5f07a624880c7766cd9a8160/1594336808166/PHASES_Guidance_Full_Report_and_Guidance_%28July_2020%29.pdf
[7] Ad esempio, l’Antiretroviral Pregnancy Registry [14] e il Registro OMS For Epidemiological Surveillance of Drug Safety in Pregnancy [15].

